盡管凝膠敷料與液體敷料在預期用途方面本無明顯分解線����,但因兩者在組成結構方面存在較大差異����,對于凝膠敷料產品注冊企業來說���,研制及注冊過程應考慮組成結構差異帶來的不同���,及相關風險識別與控制���。
盡管凝膠敷料與液體敷料在預期用途方面本無明顯分解線����,但因兩者在組成結構方面存在較大差異����,對于凝膠敷料產品注冊企業來說,研制及注冊過程應考慮組成結構差異帶來的不同�����,及相關風險識別與控制����。
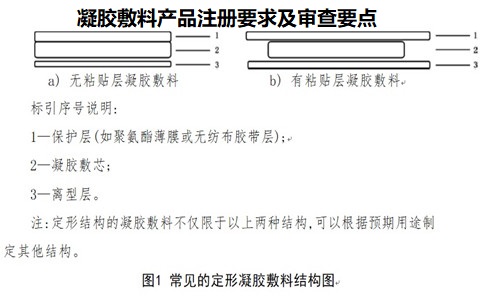
凝膠敷料產品注冊要求及審查要點:
1.凝膠敷料產品結構組成
凝膠通常由成膠物質和純化水組成。一般自身含水量超過50%���。成膠物質通常為聚丙烯酸鈉、聚乙烯醇���、卡波姆等高吸水性高分子聚合物,輔助成分根據產品預期功能和用途進行選擇添加���。凝膠敷料所含成分可能涉及很多種類,但不應具有藥理學作用���,不可被人體吸收�����。
凝膠敷料常見的成分有:聚丙烯酸鈉���、聚乙烯醇���、卡波姆����、羥乙基纖維素�����、聚乙二醇-40����、硅凝膠�����、硅酮���、海藻酸鈉���、羧甲基纖維素鈉����、聚乙烯吡咯烷酮����、聚乙二醇二丙烯酸酯等。常見的不可添加成分有:蜂蜜����、茶樹油����、奧替尼啶鹽酸鹽���、重組人表皮生長因子�����、透明質酸鈉���、維生素E�����、重組人源角蛋白、超氧化物歧化酶(SOD)�����、小分子多肽����、羧甲基殼聚糖、苯甲醇���、聚六亞甲基雙胍鹽酸鹽���、表皮生長因子�����、次沒食子酸鉍等����。
2.凝膠敷料產品適用范圍和禁忌證
2.1適用范圍
用于吸收創面滲出液或向創面排出水分����,用于手術后縫合創面等非慢性創面的覆蓋。
2.2預期使用環境
明確該產品預期使用的地點����,如醫療機構����、家庭等���。
2.3適用人群
明確目標患者人群的信息�����。
2.4禁忌證
如適用����,應當明確說明該器械不適宜應用的特定的人群或特定情況等信息。
3凝膠敷料產品技術要求
產品技術要求的制定應符合《醫療器械產品技術要求編寫指導原則》的相關法規要求�����。本條款給出需要考慮的產品主要技術指標���,如有其他指標����,注冊申請人結合相應的標準和自身的技術能力�����,予以明確���。注冊申請人如不采用以下條款(包括國家標準����、行業標準要求)�����,應當說明理由����。
3.1.1性能指標
常見的性能指標建議有以下幾點(包括但不限于此)
(1)設計特征:
具體項目包括:外觀���、尺寸����、保護層、膠粘層�����。
(2)物理性能:
無定形凝膠敷料具體項目包括:賦形性���、液體親和力���、彌散/可溶性�����、阻菌性(聲稱具有阻菌性)、黏性�����。
定形凝膠敷料具體項目包括:液體吸收性���、持粘性(帶粘貼層的)�����、剝離強度(帶粘貼層的)���、阻菌性(聲稱具有阻菌性)�����、水蒸氣透過性(聲稱具有透水蒸氣性)、舒適性(聲稱具有舒適性)、彈性(聲稱具有彈性或彈力)。
(3)化學性能:
具體項目包括:酸堿度����、重金屬。
(1)生物性能:無菌�����,或微生物限度(僅痔瘡凝膠敷料適用)應符合以下要求。
需氧菌總數 cfu /10ml | 霉菌和酵母菌總數 cfu /10ml | 金黃色葡萄球菌 | 銅綠假單胞菌 |
≤103 | ≤102 | 不得檢出 | 不得檢出 |
3.1.2檢驗方
法企業需參照相關標準制定試驗方法�����,如 YY/T 0471《接觸性創面敷料試驗方法》系列行業標準���、《中華人民共和國藥典》等�����。
由于黏度的測量與測量條件關系極大�����,建議按GB/T 10247附錄E的e)f)標注環境溫度和試驗溫度,黏度計的類型�����、名稱�����、編號及固有誤差���。此外毛細管黏度計應注明內徑����;落球黏度計應注明球的直徑���;旋轉黏度計應注明測量系統名稱����、代號及試樣用量���。
如有不適用的項目���,請予以說明���。
4.滅菌工藝研究
參考GB 18280《醫療保健產品滅菌 輻射》系列標準�����、GB 18278.1《醫療保健產品滅菌 濕熱 第1部分 醫療器械滅菌過程的開發�����、確認和常規控制要求》等相應規定,提交產品包裝及滅菌方法選擇的依據�����,經過確認并進行常規控制�����,并應開展以下方面的確認:
a.產品與滅菌過程的適應性:應考察滅菌/滅菌方法等工藝過程對于凝膠敷料的影響����。
b.包裝與滅菌過程的適應性����。
c.應明確滅菌工藝(方法和參數)和無菌保證水平(SAL)���,并提供滅菌確認報告����。無菌保證水平(SAL)應達到10-6�����。
因環氧乙烷遇水后可形成有毒的乙二醇,影響產品性能,該方法不適用于含水的液體敷料滅菌�����。常用滅菌方法有輻照滅菌����、濕熱滅菌等。