國務(wù)院印發(fā)的《“健康中國2030”規(guī)劃綱要》中明確提出,發(fā)展組學(xué)技術(shù)細胞與再生醫(yī)學(xué)、新型疫苗、生物治療等醫(yī)學(xué)前沿技術(shù);科技部重點專項中,“生物材料研發(fā)與組織器官修復(fù)替代”、“干細胞及轉(zhuǎn)化研究”位列其中;許多政策及科技項目均提出要加強再生醫(yī)學(xué)與組織工程研究工作。本文擬通過分析FDA對于該類產(chǎn)品的監(jiān)管現(xiàn)狀,對我國監(jiān)管政策制定提供參考。
國務(wù)院印發(fā)的《“健康中國2030”規(guī)劃綱要》中明確提出,發(fā)展組學(xué)技術(shù)細胞與再生醫(yī)學(xué)、新型疫苗、生物治療等醫(yī)學(xué)前沿技術(shù);科技部重點專項中,“生物材料研發(fā)與組織器官修復(fù)替代”、“干細胞及轉(zhuǎn)化研究”位列其中;許多政策及科技項目均提出要加強再生醫(yī)學(xué)與組織工程研究工作。2018年,再生醫(yī)學(xué)與組織工程等新興醫(yī)療產(chǎn)品正式列入國家藥品監(jiān)督管理局的職能范圍。隨著技術(shù)發(fā)展,相關(guān)產(chǎn)品研發(fā)和申報數(shù)量日益增多,但對于該類產(chǎn)品的監(jiān)管政策仍有待完善。本文擬通過分析FDA對于該類產(chǎn)品的監(jiān)管現(xiàn)狀,對我國監(jiān)管政策制定提供參考。
一、概況
美國食品藥品管理局(Food and Drug Administration, FDA)作為最早開始關(guān)注組織工程醫(yī)療器械產(chǎn)品安全性評價和監(jiān)督管理的重要性的機構(gòu),在1993年就組建了FDA組織工程工作組(Tissue Engineering Working Group, TEWG),由醫(yī)療器械和放射衛(wèi)生中心(CDRH)、生物制品評價研究中心(CBER)、藥品評價研究中心(CDER)和食品安全與應(yīng)用營養(yǎng)中心(CFSAN)共同參與組成。
2017年11月,F(xiàn)DA發(fā)布了監(jiān)督再生醫(yī)學(xué)產(chǎn)品的綜合政策框架,該框架包括兩份最終指導(dǎo)文件和兩份指導(dǎo)文件草案,更清楚地描述了需要上市前授權(quán)的產(chǎn)品與不需要的產(chǎn)品之間的區(qū)別。同時,由于組織工程類產(chǎn)品存在多學(xué)科交叉的現(xiàn)象且產(chǎn)品類型復(fù)雜多樣,對于藥品/器械/生物制品的組合產(chǎn)品或管理屬性有爭議的產(chǎn)品,由FDA的組合產(chǎn)品辦公室(The Office of Combination Products, OCP)根據(jù)產(chǎn)品“主要作用機理”指定產(chǎn)品上市前負主要責(zé)任的審評機構(gòu)(CDER/CDRH/CBER)。具體執(zhí)行方法為:企業(yè)向OCP提交“設(shè)計文件”(Request for Designation, R&D)用以說明產(chǎn)品的“主要作用機理”;OCP在60天的工作時限內(nèi)完成界定工作;當(dāng)企業(yè)對OCP界定結(jié)果仍存爭議時,由屬性界定委員會(兩管理機構(gòu)派一名代表組成)進行仲裁。
二、監(jiān)管機構(gòu)及法規(guī)情況
(一)監(jiān)管機構(gòu)對應(yīng)監(jiān)管的產(chǎn)品類型
FDA將用于植入、移植、輸液或轉(zhuǎn)移到人類接受者體內(nèi)的人類細胞或組織被作為人類細胞、組織和基于細胞和組織的產(chǎn)品或HCT/P進行監(jiān)管,主要由生物制品評估和研究中心(CBER)根據(jù)《聯(lián)邦法典》第21章第1270和1271部分對HCT/Ps進行監(jiān)管。
但是,由于組織工程醫(yī)療產(chǎn)品的綜合性和復(fù)雜性,F(xiàn)DA在其官網(wǎng)進一步明確了CBER和CDRH的監(jiān)管范圍,對于組織工程醫(yī)療產(chǎn)品,CDRH主要負責(zé)審評一是明確界定為醫(yī)療器械的產(chǎn)品;二是以器械為主的組合產(chǎn)品;CBER主要負責(zé)審評一是明確界定為生物制品的產(chǎn)品;二是以生物制品為主的組合產(chǎn)品;三是尚未明確界定為生物制品或醫(yī)療器械的產(chǎn)品。
同時,根據(jù)已有的審批情況,建立了“FDA對人類細胞、組織以及細胞和組織基產(chǎn)品(HCT/P’s)的監(jiān)管 產(chǎn)品列表”,該文件旨在作為檢查工具,協(xié)助FDA調(diào)查員區(qū)分由不同結(jié)構(gòu)負責(zé)監(jiān)管的產(chǎn)品,詳見下圖。
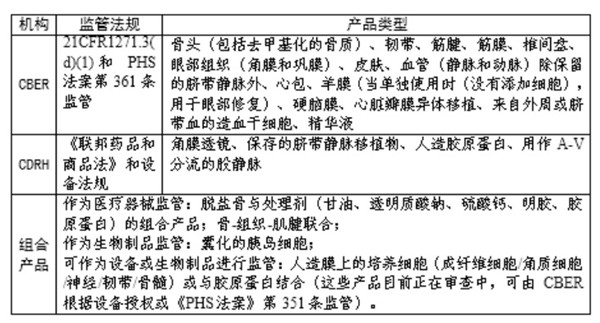
(二)監(jiān)管法規(guī)情況
(1)對于組織使用監(jiān)管:FDA對于組織的監(jiān)管是一種基于風(fēng)險的細胞和組織監(jiān)管方法。監(jiān)管重點在三個一般領(lǐng)域。1)限制傳染病從捐贈者到接受者的傳播風(fēng)險;2)建立將污染風(fēng)險降至最低的生產(chǎn)過程;3)要求對因其加工或使用而產(chǎn)生較大風(fēng)險的細胞和組織進行適當(dāng)?shù)陌踩陀行宰C明。符合第 1271.10 節(jié)標準的 HCT/Ps 只受《公共衛(wèi)生服務(wù)法》第361節(jié)的監(jiān)管。這些產(chǎn)品只需滿足21 CFR第1271部分的要求,而不需要獲得許可、批準或清關(guān)。對于不符合第1271.10節(jié)規(guī)定的標準的HCT/Ps,需要FDA進行上市前審查(包括許可證、批準或清關(guān))。
(2)對于產(chǎn)品監(jiān)管:2019年2月15日,F(xiàn)DA發(fā)布了兩項指南《針對嚴重疾病的再生醫(yī)學(xué)療法的快速審評計劃》和《基于再生醫(yī)學(xué)先進療法的醫(yī)療器械的評估》。這兩項指南旨在為細胞和基因療法研發(fā)人員提供新研發(fā)產(chǎn)品如何符合FDA快速審評計劃的明確要求。
《針對嚴重疾病的再生醫(yī)學(xué)療法的快速審評計劃》:該指南介紹了生產(chǎn)企業(yè)如何提供臨床證據(jù)來獲得RMAT認定,從而進入快速審評計劃,并提出研發(fā)人員可分別使用統(tǒng)一的規(guī)范進行加工操作,將他們的臨床數(shù)據(jù)組合在一起以支持生物制品許可證申請。快速審評計劃鼓勵生產(chǎn)企業(yè)在開發(fā)過程早期與CBER的組織和先進療法辦公室(OTAT)工作人員溝通,有助于生產(chǎn)企業(yè)和FDA工作人員討論產(chǎn)品的臨床前、臨床開發(fā)、化學(xué)、生產(chǎn)和質(zhì)控等方面的問題。
《基于再生醫(yī)學(xué)先進療法的醫(yī)療器械的評估》:討論了FDA計劃如何評估基于細胞和基因治療的醫(yī)療器械。闡述了FDA將如何簡化其監(jiān)管要求,并解釋了為什么基于再生醫(yī)學(xué)先進療法的醫(yī)療器械會被劃分為第三類醫(yī)療器械,以及為什么醫(yī)療器械應(yīng)在其說明書或其他位置標明該器械適用于哪種特定的再生醫(yī)學(xué)療法或哪一類再生醫(yī)學(xué)療法,或者標明該產(chǎn)品僅限于與特定的細胞類型或多種細胞類型配合使用。
三、監(jiān)管科學(xué)研究情況
通過上述介紹,F(xiàn)DA為更好的評估組織工程醫(yī)療產(chǎn)品的安全有效性,設(shè)立研究項目,開展了相應(yīng)的監(jiān)管科學(xué)研究工作。
(一) 通過細胞生長和成熟途徑預(yù)測用于修復(fù)受損組織和結(jié)構(gòu)的細胞和組織產(chǎn)品的安全性和有效性。
研究問題:成功開發(fā)含有活細胞的新型生物產(chǎn)品的一個主要障礙是在如何測試這些產(chǎn)品以確保其安全和有效方面存在很大的不確定性。
研究目標:該研究的目標是確定控制細胞命運決定的關(guān)鍵信號和信號途徑,以便開發(fā)改進的方法,對實驗性細胞產(chǎn)品進行分析評估,既要有過程控制,又要有可靠預(yù)測產(chǎn)品性能的發(fā)布規(guī)范。
研究過程:FDA工作組通過開展有關(guān)實驗,已經(jīng)發(fā)現(xiàn)了幾種作為控制細胞分化的信號的蛋白質(zhì)。首先,使用各種方法確定這些信號,以及對這些途徑和它們?nèi)绾慰刂平M織和器官發(fā)育進行基于計算機的數(shù)學(xué)分析。然后,測試個別分子過度表達(分子數(shù)量過多)、在錯誤的地方表達或表達不足的影響。最終,明確信號分子的作用,以及影響關(guān)鍵環(huán)節(jié)的信息。
該研究計劃利用脊椎動物的胚胎學(xué)模型,該模型對于確定控制修復(fù)和再生的關(guān)鍵生物機制以及它們之間的相互作用特別有用。
研究成果:該研究組一是已經(jīng)確定了幾個有助于控制關(guān)節(jié)形態(tài)發(fā)生、血液發(fā)育和神經(jīng)系統(tǒng)形成等過程的分子;二是發(fā)現(xiàn)了在脊椎動物的關(guān)節(jié)、眼睛、甚至整個身體計劃等復(fù)雜結(jié)構(gòu)的形成過程中,不同的蛋白質(zhì)合作實現(xiàn)對組織和器官發(fā)育的精確定位控制的方式;三是確定了新的蛋白質(zhì)和已知蛋白質(zhì)的新功能;四是對骨形態(tài)發(fā)生蛋白和信號傳導(dǎo)途徑的控制提供了新的見解。其中一些分子正在被評估為治療產(chǎn)品、測試細胞產(chǎn)品的生物標志物,或用于組織工程的試劑。
(二) 開發(fā)衡量組織工程產(chǎn)品安全性和有效性的方法
研究問題:研究決定細胞如何成熟并有助于形成器官和組織的關(guān)鍵過程。
研究目標:識別和理解分子信號,以幫助我們預(yù)測一個細胞在被施用到病人身上后將如何發(fā)揮作用。特別是了解那些決定一個細胞是保持不成熟并繼續(xù)繁殖,還是停止分裂并成熟為在體內(nèi)執(zhí)行特定功能的細胞的分子信號。研究過程:工作組在轉(zhuǎn)基因小鼠模型和人類干細胞中進行研究。工作組開發(fā)了基因工程小鼠,其中這些分子可以在某些刺激下被打開或關(guān)閉。這使我們能夠研究在組織修復(fù)和器官發(fā)育過程中何時需要這些信號。由于小鼠的器官發(fā)育與人類非常相似,我們的實驗室以小鼠為模型,研究組織如何成熟以及生物信號如何決定體內(nèi)細胞的命運。
四、基于FDA監(jiān)管方式的思考
(一)暢通小范圍試點到正常使用注冊申報道路。FDA對于創(chuàng)新產(chǎn)品持開放的態(tài)度,在嚴重疾病或小范圍內(nèi)出臺快速審批政策進行試點,然后待監(jiān)管政策及技術(shù)逐步完善后再在全社會面進行推廣使用。該方式可更好的銜接創(chuàng)新產(chǎn)品成果轉(zhuǎn)化的過程,同時給企業(yè)研發(fā)創(chuàng)新產(chǎn)品帶來動力。
(二)多渠道多方式鼓勵創(chuàng)新產(chǎn)品研發(fā)。FDA對于創(chuàng)新產(chǎn)品,除通過建立基金、暢通咨詢通道外,在考慮其安全有效性的同時,充分考慮產(chǎn)品研發(fā)、生產(chǎn)等過程中可能遇到的問題,并出臺相應(yīng)的鼓勵政策和實施建議,如臨床試驗階段樣本數(shù)量少可通過統(tǒng)一規(guī)范利用科研臨床的有關(guān)數(shù)據(jù)。該方式從多維度、多渠道切實保障創(chuàng)新產(chǎn)品研發(fā)的渠道,打通多個環(huán)節(jié)可能存在的障礙,保證創(chuàng)新產(chǎn)品順利推出。
(三)積極開展監(jiān)管科學(xué)研究。當(dāng)出現(xiàn)創(chuàng)新產(chǎn)品的時候,F(xiàn)DA會迅速組織有關(guān)機構(gòu)開展針對創(chuàng)新產(chǎn)品的評價和測試方法的監(jiān)管研究工作,在保證創(chuàng)新產(chǎn)品能盡快上市使用的同時,研發(fā)出更加快速、高效和準確的安全有效評估方法。
(文章來源:中國器審,本文章僅用于信息傳遞,不作為商業(yè)用途,如涉及侵權(quán),請聯(lián)系我司刪除。)