- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
-
第二類無源醫療器械注冊產品是否可以存在“選配件”? 我們知道,部分有源醫療器械注冊產品存在選配件這種形式,那么對于第二類無源醫療器械注冊產品,是否也可以存在“選配件”呢?如果可以的話,哪些配件可以成為“選配件”?一起看正文。 時間:2023-12-17 20:10:15 瀏覽量:705

-
手術器械類醫療器械注冊產品在什么情況下可以豁免生物學試驗? 手術類醫療器械注冊產品是醫療器械家族中最正統的一枝,是最初對醫療器械界定和定義的來源。考慮到手術類醫療器械多數都通過與人體接觸方式實現醫療目的,這種接觸類的醫療器械,是否有可能豁免生物學試驗呢?一起看正文。 時間:2023-12-17 20:02:04 瀏覽量:746

-
采用同品種比對臨床評價,同品種醫療器械包括幾種情況? 同品種比對臨床評價方式給醫療器械注冊人帶來了更多選擇,有條件采用同品種臨床評價方式,企業應優先考慮這個臨床評價路徑,相比醫療器械臨床試驗,同品種比對臨床評價方式在時間和費用方面有顯著優勢。本文為大家說說同品種醫療器械包括幾種情況?一起看正文。 時間:2023-12-17 19:52:04 瀏覽量:961

-
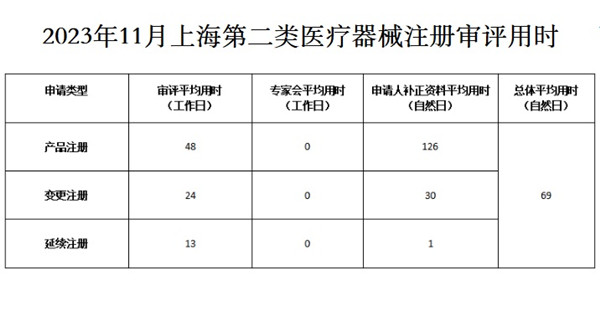
2023年11月上海第二類醫療器械注冊審評用時 來自上海藥品監督管理局發布的官網消息,2023年11月上海第二類醫療器械注冊審評平均用時48個工作日,申請人補正資料平均用時126個自然日;上海第二類醫療器械變更注冊審評平均用時24個工作日,申請人補正資料平均用時30個工作日;上海第二類醫療器械延續注冊審評平均用時13個工作日,申請人補正資料平均用時1個自然日。 時間:2023-12-16 21:26:04 瀏覽量:774
-
上海市第二類創新醫療器械特別審查申請專家審查會注意事項 近日,上海市藥監局發布《關于上海市第二類創新醫療器械特別審查申請專家審查會申請人匯報及答辯環節的提示》,提示也幫助我們更好理解第二類創新器械申請的尺度和邊界,建議擬開展第二類創新醫療器械特別審查申請的企業收藏。 時間:2023-12-16 0:00:00 瀏覽量:736

-
北京市高分子材料類醫療器械生產質量管理規范檢查指南(2023版) 為加強對高分子材料類醫療器械生產質量管理體系及其監督檢查工作,依據《醫療器械生產質量管理規范》、《醫療器械生產質量管理規范附錄無菌醫療器械》,本指南結合高分子材料類醫療器械特點,針對《醫療器械生產質量管理規范附錄無菌醫療器械》中重點檢查條款進行解釋和說明,并歸納明確了高分子材料類醫療器械生產質量管理體系中重點環節的審查要求,作為《醫療器械生產質量管理規范無菌醫療器械現場檢查指導原則》的有益補充。 時間:2023-12-15 19:08:42 瀏覽量:830

-
北京市骨科植入性醫療器械生產質量管理規范檢查指南(2023版) 為加強對骨科植入性醫療器械生產質量管理體系及其監督檢查工作,依據《醫療器械生產質量管理規范》、《醫療器械生產質量管理規范附錄植入性醫療器械》,本指南結合骨科植入類醫療器械特點,針對《醫療器械生產質量管理規范附錄植入性醫療器械》中重點檢查條款進行解釋和說明,并歸納明確了骨科植入性醫療器械生產質量管理體系中重點環節的審查要求,作為《醫療器械生產質量管理規范植入性醫療器械現場檢查指導原則》的有益補充。 時間:2023-12-15 0:00:00 瀏覽量:753

-
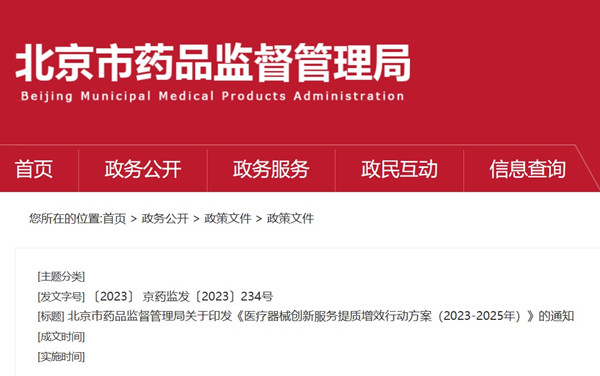
北京市藥品監督管理局醫療器械創新服務提質增效行動方案(2023-2025年) 為貫徹新發展理念,持續優化營商環境,激發企業創新動力和市場活力,提高產品競爭力,回應社會關切,更好滿足公眾安全用械需求,北京市藥品監督管理局發布《醫療器械創新服務提質增效行動方案(2023-2025年)》,行動方案將給醫療器械注冊及生產行業,給醫療器械產業帶來更大發展契機。 時間:2023-12-15 18:37:18 瀏覽量:800
-
顱內取栓支架臨床試驗注冊審查指導原則(征求意見稿) 顱內取栓支架臨床試驗注冊審查指導原則(征求意見稿)旨在指導醫療器械注冊申請人對顱內取栓支架開展臨床評價的資料準備,同時也為技術審評部門審評顱內取栓支架臨床試驗資料提供參考。本指導原則是對顱內取栓支架臨床評價的一般要求,申請人需依據產品的具體特性確定其中內容是否適用。若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對注冊申報資料的內容進行充實和細化。 時間:2023-12-13 22:15:55 瀏覽量:703

-
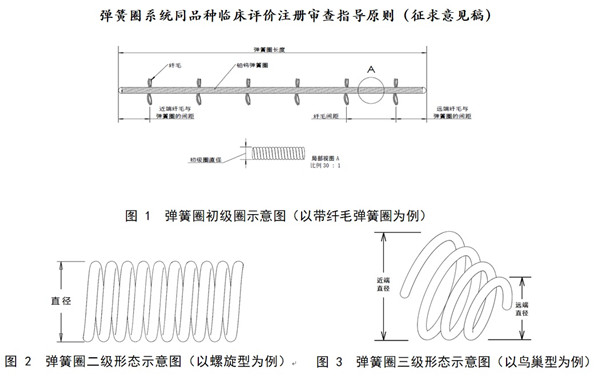
彈簧圈系統同品種臨床評價注冊審查指導原則(征求意見稿) 根據國家藥品監督管理局2023年度醫療器械注冊審查指導原則制修訂計劃的有關要求,2023年11月11日,國家藥監局發布《彈簧圈系統同品種臨床評價注冊審查指導原則(征求意見稿)》,一起看正文。 時間:2023-12-13 22:06:00 瀏覽量:1217
-
面部注射填充材料臨床試驗注冊審查指導原則(征求意見稿) 面部注射填充材料是熱門醫療器械產品之一,面部注射填充材料在我國屬于第三類醫療器械注冊?產品,國家藥監局發布的《面部注射填充材料臨床試驗注冊審查指導原則(征求意見稿)》將幫助醫療器械注冊人更好預見風險,規劃醫療器械注冊進程。 時間:2023-12-13 21:52:38 瀏覽量:1571
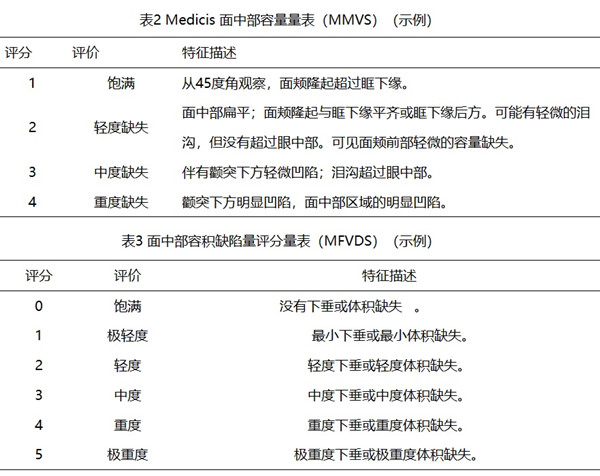
-
三個省份第二類醫療器械經營備案憑證數量超10萬張 來自國家藥監局公布的數據,截止2023年11月30日,我國累計批準第三類醫療器械經營許可證數量達到437152個,第二類醫療器械經營憑證數量達到1304539張。其中有三個省份第二類醫療器械經營備案憑證數量超過10萬,分別是廣東省第二類醫療器械經營備案憑證達到184886張;山東省第二類醫療器械經營備案憑證達到108871張;四川省第二類醫療器械經營備案憑證數量達到100588張。 時間:2023-12-12 20:21:19 瀏覽量:809

-
浙江醫療器械網絡銷售備案證數量達20162個 來自國家藥監局發布的統計數據,截止2023年11月30日,浙江醫療器械網絡銷售備案證數量達20162個,領先于江蘇醫療器械網絡銷售備案證的11054個,及上海醫療器械網絡銷售備案證的4074個。 時間:2023-12-12 20:06:50 瀏覽量:874

-
動物源性人工心臟瓣膜(外科瓣)注冊產品簡介 動物源性人工心臟瓣膜是可植入人體心臟內替代心臟瓣膜,能使血液單向流動不發生返流,具有天然心臟瓣膜功能的醫療器械,在我國屬于第三類醫療器械注冊產品。通過設計不同的縫環形狀來適應臨床上的不同瓣環位置的解剖形狀,瓣膜可以區分為兩大類:主動脈瓣和二尖瓣。 時間:2023-12-11 0:00:00 瀏覽量:809
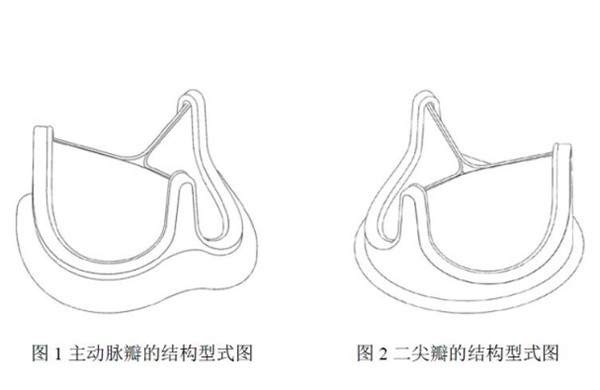
-
醫療器械注冊人委托有資質檢驗機構時,需要注意什么? 醫療器械注冊檢驗的放開,讓越來越多非藥監局下屬檢驗機構具備了醫療器械檢驗資格和范圍,讓醫療器械注冊人在醫療器械注冊檢驗時有了更多選項。第三方醫療器械注冊檢驗機構的盈利機構性質,決定了更好的服務和更市場化的價格,但是由于第三方檢驗機構需要適應的是已有的審評審批機制,需要一定的時間來累積經歷和經驗,本文為大家說說選擇第三方檢驗機構的注意事項。 時間:2023-12-11 0:00:00 瀏覽量:771

-
醫療器械變更注冊是否會開展醫療器械注冊質量管理體系核查? 不變的是變化,對于醫療器械注冊事項同樣如此。我們知道醫療器械注冊需要開展技術審評和醫療器械注冊質量管理體系核查,那如果是醫療器械變更注冊呢?是否需要開展醫療器械注冊質量管理體系核查,一起看本文。 時間:2023-12-11 0:00:00 瀏覽量:713

-
器審中心新增發布68個境外醫療器械注冊技術指導原則中文翻譯文件 為不斷優化網站服務,保持動態更新,國家藥品監督管理局醫療器械技術審評中心(以下簡稱中心)在前期工作的基礎上,持續開展國外醫療器械監管機構指導原則的翻譯工作,2023年12月08日,國家藥監局器審中心新增發布68個國外醫療器械注冊技術指導原則中文翻譯文件。 時間:2023-12-9 0:00:00 瀏覽量:936

-
《醫療器械經營質量管理規范》修訂版的主要變化 《醫療器械經營質量管理規范》(修訂版)的發布,對已經辦理醫療器械經營許可證的企業,已經辦理第二類醫療器械經營備案憑證的企業,以及準備辦理醫療器械經營許可資質的企業來說,都需要關注規范變化內容,本文為大家說說規范修訂的主要內容。 時間:2023-12-9 18:26:33 瀏覽量:851

-
《醫療器械經營質量管理規范》的修訂背景 2023年12月07日,國家藥監局發布了《醫療器械經營質量管理規范》(修訂稿),為什么會在這個時間節點修訂規范呢?這個是很多醫療器械經營許可企業問到我的問題,本文為大家介紹醫療器械經營質量管理規范的修訂背景。 時間:2023-12-9 18:16:11 瀏覽量:816

-
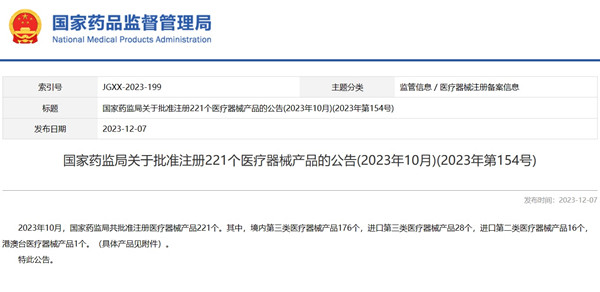
2023年10月,國家藥監局批準221個醫療器械注冊產品 2023年12月7日,國家藥監局發布醫療器械注冊審評數據,2023年10月,國家藥監局共批準221個醫療器械注冊產品。其中,境內第三類醫療器械注冊產品176個,進口第三類醫療器械注冊產品28個,進口第二類醫療器械注冊產品16個,港澳臺醫療器械注冊產品1個。 時間:2023-12-8 17:48:58 瀏覽量:1000