- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
齒科醫療器械注冊產品或許是使用者最多的醫療器械產品之一,在口腔醫院、牙科診斷等醫療機構廣泛使用。本文為大家帶來窩溝封閉劑產品注冊要求及審評要點,幫助對注冊企業、生產企業,或是使用者更多了解產品基本知識和要求。
窩溝封閉劑產品注冊要求及審評要點:
適用于能預防齲齒,封閉牙齒窩溝點隙,阻斷細菌進入和提高牙齒釉質的耐酸蝕性的樹脂基窩溝封閉劑產品,產品分類編碼17-10-04。不適用于口腔充填修復材料如水門汀類(17-05-01)、復合樹脂(17-05-05)類等III類醫療器械。窩溝封閉劑產品分類編碼為17-10-04,按照第二類醫療器械進行管理。
1.窩溝封閉劑產品分類及醫療器械注冊單元劃分
窩溝封閉劑產品按照固化方式不同,可分為兩種形式。化學固化型(I型)、外部能量固化型(II型)。外部能量固化型又分為紫外光固化型、可見光固化型。
窩溝封閉劑產品應依據《醫療器械注冊單元劃分指導原則》劃分注冊單元。劃分時應遵循以下基本原則:
1.1固化方式不同的產品應劃分為不同的注冊單元。如化學固化型與光固化型產品應劃分為不同的注冊單元。
1.2主要組成成分不同的產品應劃分為不同的注冊單元。但對于主要組成成分相同,僅著色劑不同的各型號產品可劃分到同一注冊單元,著色劑應符合相關規定。
2.窩溝封閉劑主要組成成分及工作原理
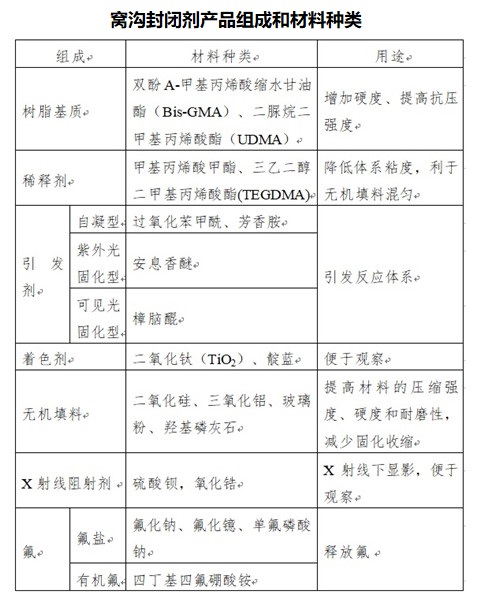
2.1樹脂基窩溝封閉劑一般由合成有機高分子樹脂基質、稀釋劑(單體)、引發劑、著色劑、無機填料組分,部分產品也會添加X射線阻射劑、氟鹽或有機氟。
2.2產品工作原理/作用機理
2.2產品固化機理
2.2.1化學固化型
樹脂基質和催化劑混合后,在催化劑作用下發生化學反應,固化完成。
2.2.2外部能量固化型
光引發劑在特定波長和強度的光線照射下,產生自由基,引發單體聚合,交聯形成聚合物。
2.3窩溝封閉劑產品工作原理
將窩溝封閉材料涂布在牙冠的咬合面和頰舌面之間的窩溝間隙,滲入到窩溝后,逐漸固化變硬,建立一層屏障,保護牙釉質不受細菌及其代謝產物、食物殘渣的侵蝕。另外,由于形成了局部密閉環境,促使殘存的細菌凋亡,進而有效防止出現窩溝齲以及繼發齲。
組成成分中包含氟的窩溝封閉劑產品除了能建立一層保護屏障外,還能利用氟與牙齒結構中羥基磷灰石結合的特性,提高牙釉質的硬度和抗酸能力,減少菌斑的形成并減少齲齒的發病率。
3.產品的適用范圍和禁忌證
3.1適用范圍/預期用途:用于封閉牙齒窩溝點隙,預防牙齒窩溝點隙處齲齒的形成。說明預期與其組合使用的器械,如牙科輸送頭、光固化型窩溝封閉劑應明確對光固化燈的波長及強度要求。
3.2預期使用環境:明確該產品預期使用的地點如醫療機構,說明可能會影響其安全性和有效性的環境條件,如光固化型窩溝封閉劑對環境中光線的特殊要求。
3.3適用人群:適用于擁有完好和初期齲壞牙齒的幼兒、兒童,明顯的齲齒應選用其他適用的方式治療。應根據患兒年齡來選擇做窩溝封閉的牙齒位置,一般做窩溝封閉的最佳時間為:乳磨牙3~4歲,第一恒磨牙7~9歲,第二恒磨牙11~13歲,雙尖牙9~13歲,另外對口腔衛生不良的兒童,雖然年齡較大或萌出時間較久,可考慮放寬窩溝封閉年齡。
3.4禁忌證應包括該產品不適用的疾病、情況及特定的人群等,如對產品成分過敏者禁用。
4.窩溝封閉劑產品技術要求
4.1產品技術要求應包括的主要性能指標
產品技術要求的制定應符合《醫療器械產品技術要求編寫指導原則》的要求。申請人應根據產品的技術特征和臨床使用情況來確定產品安全、有效的技術指標與檢驗方法。本指導原則給出窩溝封閉劑需要考慮的產品基本技術性能指標,但并未給出定量要求,可依據YY 0622制定,且性能指標不得低于強制性國家標準、行業標準。產品化學成分可在產品技術要求附錄予以明確。
窩溝封閉劑產品的主要性能指標包括:一般性能、各組分的外觀、固化的封閉劑、物理性能(I型封閉劑的工作時間、I型封閉劑的固化時間、II型封閉劑對環境光線的敏感性、II型封閉劑的固化時間、II封閉劑的固化深度、未固化膜的厚度)。
對于含氟類產品,若申請人聲稱組分中的氟在實現產品預期用途中發揮一定的作用,那么應將氟釋放特性作為一項性能指標在產品技術要求中予以明確。
此外,若申請人聲稱產品具有X射線阻射性能,建議將該指標在產品技術要求附錄中明確。
4.2同一醫療器械注冊單元內注冊檢驗用典型產品確定原則和實例
同一醫療器械注冊單元內所檢驗的型號產品應當能夠代表本注冊單元內其他型號產品的安全性和有效性。若一個型號不能覆蓋,除選擇典型性型號進行全性能檢驗外,還應選擇其他型號進行差異性檢驗。
