這周證標客服務的兩家采用醫療器械注冊人制度的企業順利通過藥監局體系考核����,在成功服務浙江省首個醫療器械注冊人制度項目之后����,也成功服務了首個杭州市余杭區醫療器械注冊人制度項目����?��?紤]到醫療器械注冊人制度的優越性�����,及越來越多的客戶咨詢到相關事項���,因此���,寫個文章為大家簡要介紹我國醫療器械注冊人制度?���。
這周證標客服務的兩家采用醫療器械注冊人制度的企業順利通過藥監局體系考核����,在成功服務浙江省首個醫療器械注冊人制度項目之后����,也成功服務了首個杭州市余杭區醫療器械注冊人制度項目?���?紤]到醫療器械注冊人制度的優越性���,及越來越多的客戶咨詢到相關事項���,因此����,寫個文章為大家簡要介紹我國醫療器械注冊人制度����。
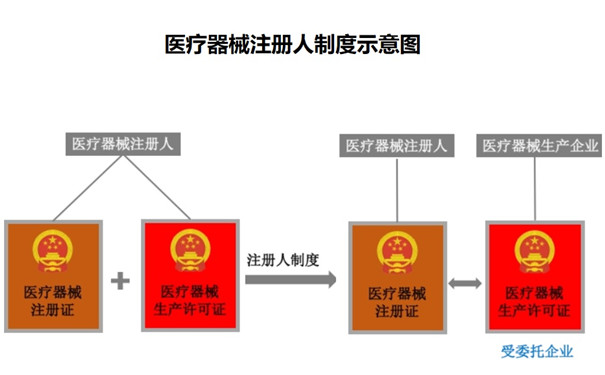
一、什么是醫療器械注冊人制度�����?
醫療器械注冊人在注冊申報以及生產時可將產品委托給不同的生產商生產����,但注冊人對醫療器械全生命周期負主體責任,這種制度稱為注冊人制度���。
符合條件的醫療器械注冊申請人申請并取得醫療器械注冊證后成為醫療器械注冊人(簡稱“注冊人”)。其核心要義是注冊人以自身名義將產品推向市場,對產品全生命周期負責����。醫療器械注冊人制度將醫療器械注冊證和生產許可證進行剝離���,醫療器械注冊人可以將其注冊的產品委托給一家或多家滿足要求的生產企業����。提到“醫療器械注冊人”這個名詞����,不得不先來認識另外一個與之密切相關的名詞——“上市許可持有人/MAH(Marketing Authorization Holder)”。2018年8月13日發布的《醫療器械不良事件監測和再評價管理辦法》,是中國藥監部門第一次在正式法規文件中使用了“醫療器械上市許可持有人”這個稱呼���。其中第四條規定:醫療器械上市許可持有人����,是指醫療器械注冊證書和醫療器械備案憑證的持有人,即醫療器械注冊人和備案人。從定義不難看出�����,醫療器械上市許可持有人/MAH有兩種類型����,而醫療器械注冊人只是其中之一。如果一個公司僅僅擁有醫療器械備案憑證(即第一類醫療器械上市資格)�����,那么它應該被稱為“醫療器械備案人”�����,而不是“醫療器械注冊人”�����。但是,由于目前醫療器械行業內通常把焦點放在需要上市審批的產品和企業上�����,所以當我們現在提起“上市許可持有人”或“MAH”時�����,通常是默認指向醫療器械注冊人���,而這兩者實際上是有區別的����。(一)醫療器械注冊人制度出現前
2000年,我國才擁有了第一部醫療器械專業法規——《醫療器械監督管理條例》����。在此之前我國的醫療器械產品大多仿自國外大型廠商的名牌產品�����,100%的國產產品少之又少。本身是在別人技術的基礎上進行的“二次開發”�����,受限于法規����、專利和版權的問題,也就不好拿出去委托第三方生產了���。
2000年以后,隨著國內器械廠商技術積累的豐富和研發能力的壯大����,行業內迎來了一段時間的新產品上市熱����。但是���,由于當時我國基礎領域研究能力仍顯不足���,為保證產品質量�����,很多企業的設計和生產團隊需要頻繁的磨合,甚至只能采取邊生產邊改進工藝的方式�����。注冊證的持有者不能�����、也不敢將研發和制造環節輕易地脫鉤���。
2010年以后���,特別是2015年以后���,隨著我國各項基礎研究領域的發展����,研發和制造管理各領域的參與者也積攢了豐富的實踐經驗�����,MAH的話題又被行業內的先行者們提了出來���。但是,當時由于我國物權、專利權���、合同、產品質量等相關法律法規的不健全����,整體市場環境并不接受MAH這種高信任度的經濟合作模式����。國內各專業領域細分并未形成良好的整體可信度,再加上企業自身品控水平不一、信用良莠不齊����,監管部門雖有考慮逐步放開產品上市模式����,但始終沒有下定決心���。
雖然沒有上市許可持有人MAH制度����,但當時國內企業還是可以通過委托生產的方式來完成生產方式的轉移。當然這個生產轉移是有限的:僅允許企業在取得產品注冊(已具備上市許可和生產許可)后���,采取委托生產的方式轉移生產環節,同時要求委托雙方都須具有生產許可資質����。
這種委托生產的方式不同于前文所說的醫療器械注冊人制度�����,委托生產是不允許上市申請人以委托的方式取得產品上市許可批準的����。同樣的,市場中常見的資格證書轉移行為也被禁止���,監管部門也沒有為類似情況留出“政策空間”。不可否認的是����,當時的法規政策限制了一批合理合法完成企業兼并�����、重組的行為,使一部分醫療器械產品首次上市申請和上市資格轉移的訴求得不到主張���。
(二)醫療器械注冊人制度試點階段
隨著上海邁出了醫療器械注冊人試點的第一步,廣東和天津也陸續加入到了試點的行列���。2019年,為了更好的收集行業反饋�����、擴大試點效果���,國家藥品監督管理局更是將試點范圍擴大到了北京����、天津、河北�����、遼寧����、黑龍江���、上海�����、江蘇����、浙江、安徽�����、福建�����、山東�����、河南、湖北���、湖南、廣東����、廣西����、海南����、重慶�����、四川���、云南���、陜西等21個省�����、自治區、直轄市����。
(三)醫療器械注冊人制度全面推廣及法規體系建設加速完善
2017年�����,中辦、國辦兩辦發布《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》,明確實施注冊人制度���,國家藥監局隨后在上海、廣東、天津等?����。ㄊ校﹩幼匀酥贫仍圏c�����。2019年,《關于進一步擴大醫療器械注冊人制度試點工作的通知》發布�����,試點省份擴大到22個�����。2021年6月1日新修訂《醫療器械監督管理條例》實施����,標志著注冊人制度在全國范圍內正式生根落地����。
配套新修訂《條例》實施�����,國家局在2021年修訂發布了《醫療器械注冊管理辦法》《體外診斷試劑注冊管理辦法》,今年3月份又修訂發布了《醫療器械生產監督管理辦法》《醫療器械經營監督管理辦法》,并第一時間配套發布了《關于加強醫療器械跨區域委托生產協同監管工作的意見》、《關于發布醫療器械委托生產質量協議編制指南的通告》等一系列配套文件���。據統計,截至目前,我國已經形成了以《醫療器械監督管理條例》為核心���,13部配套規章、140余個配套規范性文件、490余份技術指導原則為支撐���,較為完備的全生命周期監管法規體系。
“我們從法規體系上進一步明確醫療器械注冊人、受托生產企業的責任和義務���,明確醫療器械注冊人對上市醫療器械全生命周期的產品質量安全依法承擔責任要求�����?����!眹宜幈O局醫療器械監管司王者雄司長介紹,從法規層面歸納起來有三個主要特點�����,即:醫療器械注冊人對所上市產品質量安全全面負責�����、受托生產企業對生產行為負責并接受注冊人的監督�����、醫療器械注冊人所在地省級藥品監管部門全面負責對醫療器械注冊人的監督管理。
國家局還結合監管實際���,對原有的《醫療器械生產企業分類分級監督管理規定》、《醫療器械經營企業分類分級監督管理規定》進行了修訂�����,形成了《關于加強醫療器械生產經營分級監管工作的意見》����,目前正在面向社會公開征求意見����。
目的是綜合運用科學監管、信用監管和智慧監管等手段,全方面多角度加強對醫療器械注冊人和受托生產企業的監管����?����!蓖跽咝蹚娬{,要堅決杜絕監管盲區����、消除監管漏洞���,全面指導屬地監管部門有效落實監管責任���,企業有效落實產品質量安全主體責任�����。
杭州證標客醫藥技術咨詢有限公司是全國最早開展醫療器械注冊人制度咨詢服務的機構之一,任何有關醫療器械注冊人制度相關咨詢,歡迎您隨時方便與杭州證標客醫藥技術咨詢有限公司聯絡����,聯系人:葉工���,電話:18058734169�����,微信同。