前車之鑒�,后事之師。近日����,上海藥監局發布《2022年上海市第二類有源醫療器械變更注冊技術審評常見問題分析》�,2022年上海市醫療器械化妝品審評核查中心共計受理第二類有源醫療器械變更注冊157件�,其中40件進行了發補,發補率25.4%。下面對技術審評發補常見問題進行分析。
前車之鑒,后事之師。近日����,上海藥監局發布《2022年上海市第二類有源醫療器械變更注冊技術審評常見問題分析》����,2022年上海市醫療器械化妝品審評核查中心共計受理第二類有源醫療器械變更注冊157件�����,其中40件進行了發補����,發補率25.4%�。下面對技術審評發補常見問題進行分析�。
一、上海第二類有源醫療器械變更注冊審評發補意見分布情況
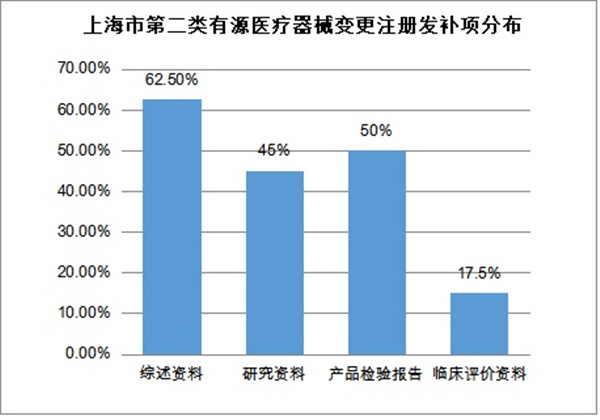
變更注冊發補40件����,涉及33家企業�。主要集中在綜述資料�����、研究資料�����、產品檢驗報告�、臨床評價資料�����、注冊單元及產品管理類別�����、申請表六部分。其中綜述資料發補率62.5%,研究資料發補率45%,產品檢驗報告50%�,臨床評價資料發補率17.5%�。
二�、醫療器械變更注冊審評常見問題分析
1、醫療器械注冊單元及產品管理類別問題
根據《醫療器械注冊單元劃分指導原則》,產品技術原理�����、結構組成����、性能指標����、適用范圍不同時,原則上劃分為不同注冊單元�。例如移動式攝影X射線機進行變更注冊時�����,以新增型號高壓發生器為例,需要詳述變更高壓發生器后�,新增產品型號與原產品型號屬于同一注冊單元的理由�,包括原材料�、結構組成等。高壓發生裝置中的高壓變壓器結構不一致的(如:工頻和非工頻)�,不能劃為同一注冊單元�,建議企業進行首次注冊申報�。
部分產品變更注冊后產品管理類別發生變化,例如醫學影像處理軟件變更后可提供治療計劃制定等臨床診療建議����,變更后的產品應按照第三類醫療器械管理����,建議企業在提交資料前應明確產品管理類別�����。
2�、申請表常見問題
申請表中“變更內容”描述不清�,或與提交的《變更情況說明》中的變更內容不一致。如《申請表》中描述產品結構組成有變化����,但《變更情況說明》中陳述變更內容不涉及產品結構組成的變化����?���!渡暾埍怼窇敿毭枋鲂枰M行變更注冊的內容�����,如有必要�����,請以《申請表》的附件形式進行詳細、完整的描述����。
3�����、綜述資料常見問題
企業未根據《關于公布醫療器械注冊申報資料要求和批準證明文件格式的公告》編寫申報產品的綜述資料����,存在主要問題如下:
(1)產品變更情況說明:對變更的具體內容描述不充分�����,無法充分了解產品變更內容����。未詳細描述產品變更部分的工作原理�、技術參數����、結構組成和涉及的軟硬件變動及臨床操作使用情況;變更新增型號命名不合理����,劃分說明未體現型號間差異����;未提供新增型號產品的主要元器件清單(包括元器件的名稱�、型號、技術參數、材質�、供應商信息等)和新增型號產品的彩色照片����,根據產品具體變更情況提供相應的說明對比表�。
(2)綜述資料涉及軟件相關部分:未按《醫療器械軟件注冊審查指導原則(2022年修訂版)》提交軟件更新資料;未提交新增軟件功能的詳細設計說明,未明確新增軟件功能涉及的核心算法及相關參數�����。
4�����、研究資料常見問題
(1)性能研究:未對變更的差異部分對產品安全有效性的影響進行風險分析����;涉及新增部件或原材料變化�����,未判斷變更部分對產品有效性的影響�,以纖維輸尿管腎鏡新增型號為例�,新增產品型號在結構組成中增加不銹鋼管部分����,增加該部分后,需提供產品的理化性能�����、光學性能�、電氣絕緣性能、防水性能�、連接頭拉力性能等方面的研究資料�����;
(2)軟件研究:涉及軟件變化及新增軟件模塊,未按照軟件指導原則提供相應資料�����,例如視力篩選儀新增了光反射軟件功能�����,但申報資料對此功能的相關功能原理�����、相關指標要求及相關依據性資料未進行詳細介紹且未提供相應的依據性資料�����。
5、產品檢驗報告常見問題
未提交針對性能指標及檢驗方法實質性變更的檢驗報告,常見問題有:
(1)未提交性能指標和檢驗方法變化的合理理由�����;
(2)未提交性能指標和檢驗方法變化后的產品檢驗報告�;
(3)檢驗報告未包括涉及變更部分全部項目的檢驗結果�。
6、臨床評價資料常見問題
企業申請變更適用范圍�,但未提交相應的臨床評價資料����,如人工耳蝸聲音處理器更改產品適用范圍�����,在原適用范圍中增加了適配的人工耳蝸植入體型號�����,但未提交相應的臨床評價資料。
備注:以上分析按照《關于公布醫療器械注冊申報資料要求和批準證明文件格式的公告》的申報資料先后順序排序�����。
三�����、 對上海市第二類有源醫療器械變更注冊的建議
本文對2022年上海市第二類有源醫療器械變更注冊常見發補問題進行了梳理與分析�����,其中最常見的三個主要問題集中在:綜述資料、產品檢驗報告����、研究資料。
綜述資料部分����,企業應當詳細描述本次變更情況����、變更的具體原因及目的�����,讓審評人員對變更產品能有整體的把握和了解�,使產品的風險能更清晰地被識別�����。在產品變更情況描述部分����,根據產品具體變更情況提供相應的說明及對比表�,包括產品技術要求變更對比表,結構組成對比表�,適用范圍對比表等�����。
關于研究資料,建議企業根據《關于公布醫療器械注冊申報資料要求和批準證明文件格式的公告》進行編寫�,根據變更產品的技術特征�����,提供研究綜述,逐項描述所開展的研究,提供相應的研究資料����。研究資料應當包括產品性能指標的確定依據����、設計輸入來源等內容����。研究資料應當足夠充分,能夠證明產品的安全性和有效性。對于包含軟件組件的產品�����,也應當根據《醫療器械軟件注冊審查指導原則(2022年修訂版)》的要求提交產品軟件研究資料�。
在產品檢驗報告部分,應關注產品技術要求變化部分,應提供變化后的檢驗報告�����,檢驗報告應包括變更部分的全項檢測�,送檢樣品應能覆蓋所有型號規格。
如有上海第二類醫療器械變更注冊咨詢服務需求����,歡迎您隨時方便與杭州證標客醫藥技術咨詢有限公司聯絡�����,聯系人:葉工,電話:18058734169,微信同�����。