- 醫療器械注冊
- 第二類醫療器械注冊 第三類醫療器械注冊 進口醫療器械注冊 第一類醫療器械備案 體外診斷試劑注冊 醫療器械注冊體系考核 醫療器械生產許可證
- 醫療器械CE認證
- 醫療器械CE認證 FDA注冊(備案) 醫療器械境外注冊服務 ISO13485認證 ISO15378醫療包材體系認證 MDSAP認證服務 ISO13485內審員培訓
- 醫療器械臨床試驗
- 醫療器械臨床試驗服務 同品種比對臨床評價 體外診斷試劑(IVD)臨床試驗服務 臨床協調員(CRC)服務 進口醫療器械補充臨床試驗服務 醫院臨床試驗機構備案服務 醫療器械主文檔登記
- 醫療器械經營許可
- 醫療器械經營許可證辦理 第二類醫療器械經營備案 醫療器械網絡銷售備案 醫療器械分類界定代辦 醫療器械飛行檢查服務 醫療器械注冊檢驗資質 獸藥經營許可證辦理
- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
-
液脈動干眼治療儀臨床試驗設計實例 口腔科器械、眼科器械、醫美器械是非常熱門醫療器械細分類別,伴隨著電子產品在生活中的深度、廣度參與,以及人口老齡化進程,眼科器械近年及未來很長一段時間都是增量需求。本文為大家說說用于干眼癥治療的液脈動干眼治療儀臨床試驗設計實例,一起看正文。 時間:2024-12-26 20:52:49 瀏覽量:30
-
心臟脈沖電場消融儀臨床試驗設計實例 心臟脈沖電場消融儀在我國屬于第三類醫療器械注冊產品,且不在免于醫療器械臨床試驗目錄內,因此,醫療器械注冊人需要通過醫療器械臨床試驗或是同品種對比臨床評價方式完成臨床評價,本文為大家介紹心臟脈沖電場消融儀臨床試驗設計實例,一起看正文。 時間:2024-12-21 19:03:45 瀏覽量:104

-
第三類醫療器械臨床試驗設計實例(人工血管) 近日,國家藥監局公開了人工血管這個第三類醫療器械的注冊審評報告,對于第三類醫療器械來說,注冊申請人對如何開展醫療器械臨床試驗非常關心,本文為大家說說人工血管臨床試驗設計實例,一起看正文。 時間:2024-12-14 21:10:36 瀏覽量:123

-
碳離子治療系統同品種臨床評價成功案例 ?提供碳離子束用于成人惡性實體腫瘤治療的碳離子治療系統,由加速器子系統和治療子系統組成,其中加速器 子系統包括注入器系統、主加速系統、加速器輔助系統,治療子系統包括 4 個治療室、物理計劃室和共用部分。碳離子治療系統在我國屬于第三類醫療器械注冊產品,且不在免于開展醫療器械臨床試驗目錄之內,今天為大家介紹碳離子治療系統同品種臨床評價成功案例,一起看正文。 時間:2024-12-4 23:07:20 瀏覽量:272

-
超聲診斷系統同品種臨床評價成功案例 超聲診斷系統在我國屬于第三類醫療器械注冊產品,其不在當前免于開展醫療器械臨床試驗目錄內,因此,醫療器械注冊人需要通過同品種臨床評價或是醫療器械臨床試驗完成臨床評價,考慮到同品種臨床評價相比醫療器械臨床試驗在費用和周期方面的優勢,本文為大家介紹超聲診斷系統同品種臨床評價成功案例,一起看正文。 時間:2024-12-2 20:04:07 瀏覽量:329

-
熒光成像功能醫療器械注冊產品同品種臨床評價要點 ?熒光成像功能不屬于已列入《免于臨床評價醫療器械目錄(2021年)》(簡稱《目錄》)產品的功能,醫療器械注冊人需要通過同品種臨床評價或是醫療器械臨床試驗完成產品的臨床評價,考慮到同品種臨床評價的可行性及相比醫療器械臨床試驗的巨大優勢,本文為大家介紹熒光成像功能醫療器械注冊產品同品種臨床評價要點。 時間:2024-11-29 20:47:44 瀏覽量:302

-
注冊用途體外診斷試劑臨床試驗應選擇多少家臨床試驗機構? 對于不在免于開展體外診斷試劑臨床試驗目錄內的產品來說,體外診斷試劑擬上市注冊臨床試驗應選擇多少家臨床試驗機構開展臨床試驗? 時間:2024-10-30 20:41:34 瀏覽量:420

-
第二類醫療器械臨床試驗核查評價依據是什么? 醫療器械臨床試驗核查日趨頻繁,對于開展醫療器械臨床試驗的第二類醫療器械注冊人來說,熟悉并滿足第二類醫療器械臨床試驗核查評價依據是基本課題。本文為醫療器械注冊申請人說說,申請注冊產品需進行第二類醫療器械臨床試驗核查的,其核查評價依據是什么?一起看正文。 時間:2024-8-31 20:49:12 瀏覽量:1123

-
浙江省醫療器械臨床試驗備案流程和要求 《醫療器械監督管理條例》第二十六條規定:開展醫療器械臨床試驗,應當按照醫療器械臨床試驗質量管理規范的要求,在具備相應條件的臨床試驗機構進行,并向臨床試驗申辦者所在地省、自治區、直轄市人民政府藥品監督管理部門備案。接受臨床試驗備案的藥品監督管理部門應當將備案情況通報臨床試驗機構所在地同級藥品監督管理部門和衛生主管部門。本文為大家介紹浙江省醫療器械臨床試驗備案流程和要求。 時間:2024-7-29 21:59:31 瀏覽量:1244

-
第二類醫療器械臨床試驗申報資料常見問題 按照補正通知書的要求,醫療器械注冊人應在一年內一次性提交補正資料。因此,醫療器械企業應盡力避免出現醫療器械臨床試驗相關補正項。本文為大家介紹第二類醫療器械臨床試驗申報資料常見問題,一起來關注。 時間:2024-4-1 22:14:46 瀏覽量:1260

-
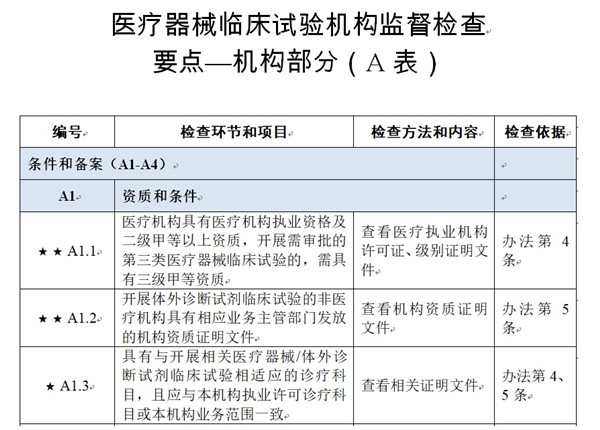
醫療器械臨床試驗機構監督檢查要點及判定原則(二次征求意見稿) 為加強醫療器械臨床試驗機構(以下簡稱機構)管理,規范臨床試驗機構監督檢查工作,根據《醫療器械注冊與備案管理辦法》《體外診斷試劑注冊與備案管理辦法》《醫療器械臨床試驗機構條件和備案管理辦法》(以下簡稱“辦法”)《醫療器械臨床試驗質量管理規范》(以下簡稱“GCP”)等有關規定,制定本檢查要點。 時間:2024-3-12 19:20:05 瀏覽量:1472
-
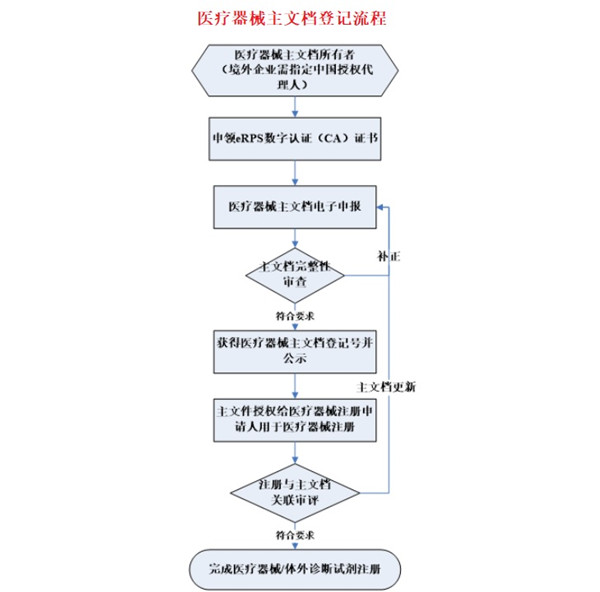
一文讀懂醫療器械主文檔登記 如果您之前接觸過藥包材登記事項或是藥用原輔料登記事項,那您就很容易理解醫療器械主文檔登記事項。如果您是第一次接觸醫療行業,那也沒關系,我盡力在這篇文章中把主文檔登記講通透。 時間:2024-3-11 19:51:02 瀏覽量:1893
-
醫療器械真實世界研究設計和統計分析注冊審查指導原則(2024年第3號) 2024年1月15日,為進一步引導醫療器械真實世界研究的規范開展,國家藥監局器審中心發布《醫療器械真實世界研究設計和統計分析注冊審查指導原則》,本原則旨在規范和合理引導真實世界數據在醫療器械臨床評價中的應用,詳見正文。 時間:2024-1-16 17:23:38 瀏覽量:1259

-
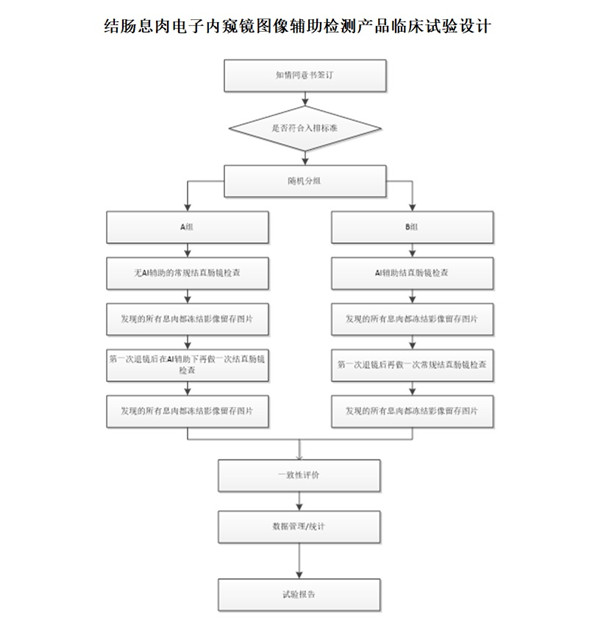
結腸息肉電子內窺鏡圖像輔助檢測產品臨床試驗設計 結腸息肉電子內窺鏡圖像輔助檢測產品臨床試驗設計 時間:2023-11-8 19:19:48 瀏覽量:1274
-
軟性接觸鏡臨床評價注冊審查指導原則(2023年第33號) 2023年8月23日,為進一步規范軟性接觸鏡醫療器械的管理,國家藥監局器審中心組織制定了《軟性接觸鏡臨床評價注冊審查指導原則》,并與今日發布,詳見正文。 時間:2023-8-23 16:07:15 瀏覽量:1335
-
醫療器械臨床試驗嚴重不良事件網絡上報的法規依據 醫療器械臨床試驗嚴重不良事件網絡上報的法規依據是什么?我國對醫療器械臨床試驗中不良事件報告的法規主要有二個,一是《醫療器械臨床試驗質量管理規范》,二是《國家藥監局關于實施<醫療器械臨床試驗質量管理規范>有關事項的通告》(2022年第21號),相關規定見正文。 時間:2023-8-15 22:38:21 瀏覽量:1757

-
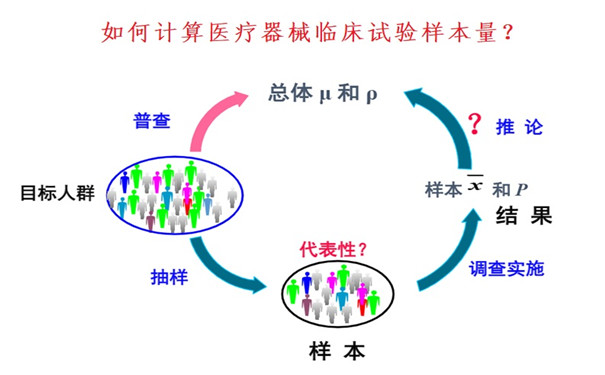
如何計算醫療器械臨床試驗樣本量? 如何計算醫療器械臨床試驗樣本量?或者我們這個臨床試驗需要多少例受試者?是高頻被客戶問到,但又沒法一口回答的問題。如同被問到我這個醫療器械臨床試驗要多少錢,一樣沒法直接回答一樣。因為,無論是臨床試驗的樣本量,還是臨床試驗的費用,取得多個產品因素和非產品因素。 時間:2023-7-4 15:16:22 瀏覽量:2200
-
海南博鰲樂城國際醫療旅游先行區醫療器械臨床真實世界數據應用前置溝通工作實施辦法(試行) 2023年4月底,國家藥品監督管理局醫療器械技術審評中心會同海南省藥品監督管理局、海南博鰲樂城國際醫療旅游先行區管理局聯合發布《海南博鰲樂城國際醫療旅游先行區醫療器械臨床真實世界數據應用前置溝通工作實施辦法(試行)》,這是自2019年海南省人民政府與國家藥品監督管理局聯合開展博鰲樂城國際醫療旅游先行區臨床真實世界數據應用試點工作之后,為進一步深化、常態化醫療器械真實世界數據應用工作新的舉措。 時間:2023-4-28 21:19:19 瀏覽量:1806

-
急性動物實驗與慢性動物實驗的區別 急性動物實驗與慢性動物實驗的區別 時間:2023-4-1 16:31:52 瀏覽量:4651

-
髖關節假體同品種臨床評價注冊審查指導原則(征求意見稿) 髖關節假體同品種臨床評價注冊審查指導原則旨在指導注冊申請人對髖關節假體開展同品種臨床評價,同時也為技術審評部門審評髖關節假體同品種臨床評價資料提供參考。杭州證標客醫藥技術咨詢有限公司是自2017年起,為廣大客戶提供醫療器械同品種比對臨床評價服務公司,有許多醫療器械同品種比對臨床評價成功案例。 時間:2022-10-30 11:19:38 瀏覽量:2029