- 聯系我們

聯系電話:0571-86198618手機: 18058734169 (微信同)手機:18868735317(微信同)周一至周日 8:00~22:00
在線客服周一至周日 8:00~22:00
-
從仿制到創新,創新醫療器械注冊審批之路越走越平坦 盡管新中國醫療器械有序監管之路起步相對較晚,但從第一個醫療器械監管法規制定之日起,領導層就高瞻遠矚、逐步為創新醫療器械注冊審評建立秩序,鋪平道路。自2014年2月,國家藥監部門發布《創新醫療器械特別審批程序(試行)》,不斷為創新醫療器械注冊審評出臺專項制度,有序推進醫療器械產業創新發展。僅2022年初至今,我國獲批上市的創新醫療器械就達到44個,這一數字早已超過了2021年全年的數字。 時間:2022-10-14 12:28:55 瀏覽量:1246

-
寨卡病毒核酸檢測試劑注冊審查指導原則(征求意見稿) 寨卡病毒核酸檢測試劑注冊審查指導原則(征求意見稿)旨在指導注冊申請人對寨卡病毒核酸檢測試劑注冊申報資料的準備及撰寫,同時也為技術審評部門提供參考。本指導原則是對寨卡病毒核酸檢測試劑的一般要求,體外診斷試劑注冊申請人應依據產品的具體特性確定其中內容是否適用。若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對注冊申報資料的內容進行充實和細化。 時間:2022-10-12 9:28:21 瀏覽量:1100

-
一次性使用靜脈營養輸液袋注冊審查指導原則(征求意見稿) 一次性使用靜脈營養輸液袋注冊審查指導原則(征求意見稿)旨在指導醫療器械注冊申請人對一次性使用靜脈營養輸液袋(以下簡稱“靜脈營養袋”)注冊申報資料的準備及撰寫,同時也為技術審評部門對注冊申報資料的審評提供參考。 時間:2022-10-12 9:17:28 瀏覽量:1215

-
牙科粘接劑產品注冊審查指導原則(征求意見稿) 2022年10月10日為規范產品技術審評,指導醫療器械注冊申請人進行牙科粘接劑產品注冊申報,藥監總局起草了《牙科粘接劑產品注冊審查指導原則(征求意見稿)》,現向社會公開征求意見。 時間:2022-10-10 10:50:19 瀏覽量:1493

-
11月起,藥監總局發放藥品電子注冊證 2022年10月09日,國家藥監局發布《關于發放藥品電子注冊證的公告(2022年 第83號)》,自2022年11月1日起,發放藥品電子注冊證。 時間:2022-10-10 10:40:12 瀏覽量:1482

-
總局抽檢電動輪椅等12個品種,發現26批產品不合格 近日,國家藥監局發布國家醫療器械監督抽檢結果的通告(第3號)(2022年第45號),組織對電動輪椅等12個品種進行了產品質量監督抽檢,發現26批(臺)產品不符合標準規定。對于醫療器械生產企業來說,發現問題不只要做好醫療器械飛行檢查整改?,更重要的是建立長效機制,確保持續合規。 時間:2022-10-10 10:34:38 瀏覽量:1752

-
一次性使用輸注器具產品注冊審查指導原則(2022年修訂版) 一次性使用輸注器具產品注冊審查指導原則(2022年修訂版),旨在幫助和指導醫療器械注冊申請人對一次性輸注器具產品注冊?申報資料進行準備,同時也為技術審評部門提供參考。本指導原則是對次性使用輸注器具產品注冊申報資料的一般要求,注冊申請人應依據具體產品的特性對注冊申報資料的內容進行充實和細化。注冊申請人還可依據具體產品的特性確定其中的具體內容是否適用,若不適用,需具體闡述其理由及相應的科學依據。 時間:2022-10-8 0:00:00 瀏覽量:1585

-
一次性使用避光輸液器產品注冊審查指導原則(2022年修訂版)( 征求意見稿) 一次性使用避光輸液器產品注冊審查指導原則(2022年修訂版)( 征求意見稿),旨在幫助和指導醫療器械注冊申請人對一次性使用避光輸液器(以下簡稱避光輸液器)產品注冊申報資料進行準備,同時也為技術審評部門提供參考。 時間:2022-10-8 0:00:00 瀏覽量:1531

-
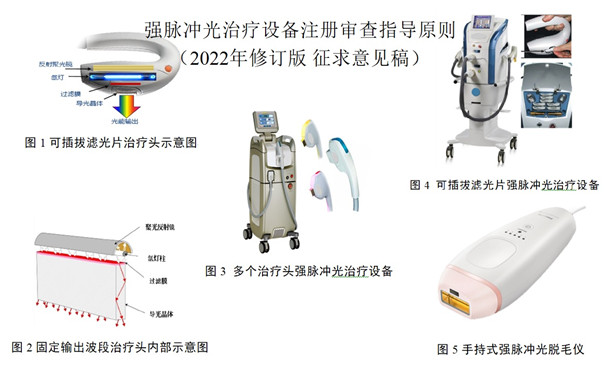
強脈沖光治療設備注冊審查指導原則(2022年修訂版)(征求意見稿) 2022年10月8日,為規范產品技術審評,指導醫療器械注冊人進行強脈沖光治療設備注冊申報,藥監總局對原《強脈沖光治療設備注冊審查指導原則》進行了修訂,并形成了《強脈沖光治療設備注冊審查指導原則(2022年修訂版)(征求意見稿)》,自即日起面向社會公開征求意見。詳見正文。 時間:2022-10-8 12:51:24 瀏覽量:1693
-
牙齒種植體系統注冊綜述資料中結構設計應考慮哪些方面? 隨著人民對口腔健康的日益重視,齒科器械成為最熱門醫療器械細分領域之一,牙齒種植體系統注冊產品對比正畸矯形器械,有更高的入門條件,也有更高的單體利潤和企業護城河。本文來說說牙齒種植體系統注冊綜述資料中結構設計應考慮哪些方面? 時間:2022-10-6 16:26:54 瀏覽量:1285

-
無菌醫療器械注冊產品初包裝變化,是否需要開展生物學試驗? 對于無菌醫療器械注冊?產品來說,初包裝不僅影響產品的貨架有效期,也一定程度的影響產品的性能。在產品注冊檢驗和醫療器械注冊審評時,關于無菌包裝的理解,也時常出現因人而異的理解和判定。考慮到更換包裝對無菌醫療器械注冊企業來說是大概率會遇到的情況,本文來說說無菌醫療器械注冊產品初包裝變化,是否需要開展生物學試驗這個高頻被問到的事項。 時間:2022-10-6 0:00:00 瀏覽量:1382

-
EB病毒抗體檢測試劑注冊審查指導原則(2022年第36號) EB病毒抗體檢測試劑注冊審查指導原則(2022年第36號)旨在指導注冊申請人對EB病毒抗體檢測試劑注冊申報資料的準備及撰寫,同時也為技術審評部門對注冊申報資料的技術審評提供參考。本指導原則是針對EB病毒抗體檢測試劑注冊審查的一般要求,申請人應依據產品的具體特性確定其中內容是否適用,若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對注冊申報資料的內容進行充實和細化。 時間:2022-10-4 10:47:06 瀏覽量:1421

-
人類免疫缺陷病毒抗原抗體檢測試劑臨床前注冊審查指導原則(2022年第36號) 人類免疫缺陷病毒抗原抗體檢測試劑臨床前注冊審查指導原則(2022年第36號)旨在指導醫療器械注冊申請人對人類免疫缺陷病毒抗原抗體檢測試劑性能評價研究注冊申報資料的準備及撰寫,同時也為技術審評部門對注冊申報資料的技術審評提供參考。本指導原則是對人類免疫缺陷病毒抗原抗體檢測試劑的一般要求。 時間:2022-10-4 0:00:00 瀏覽量:1752

-
戊型肝炎病毒IgM/IgG抗體檢測試劑注冊審查指導原則(2022年第36號) 戊型肝炎病毒IgM/IgG抗體檢測試劑注冊審查指導原則(2022年第36號)旨在指導注冊申請人對戊型肝炎病毒IgM/IgG抗體檢測試劑注冊申報資料的準備及撰寫,同時也為技術審評部門提供參考。本指導原則是對戊型肝炎病毒IgM/IgG抗體檢測試劑的一般要求,注冊申請人應依據產品的具體特性確定其中內容是否適用。 時間:2022-10-4 10:35:14 瀏覽量:1727

-
質控品注冊審查指導原則之質控品賦值研究(2022年第36號) 質控品注冊審查指導原則之質控品賦值研究(2022年第36號)旨在指導注冊申請人對注冊申報資料中質控品賦值研究資料的準備及撰寫,同時也為技術審評部門審評注冊申報資料提供參考。本指導原則是對質控品賦值研究的一般要求,申請人應依據產品的具體特性確定其中內容是否適用,若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對注冊申報資料的內容進行充實和細化。 時間:2022-10-4 10:29:13 瀏覽量:2920

-
體外診斷試劑參考區間確定注冊審查指導原則(2022年第36號) 體外診斷試劑參考區間確定注冊審查指導原則(2022年第36號)旨在指導醫療器械注冊申請人對注冊申報資料中參考區間研究資料的準備及撰寫,同時也為技術審評部門審評注冊申報資料提供參考。本指導原則是對體外診斷試劑參考區間確定的一般要求,申請人應依據產品的具體特性確定其中內容是否適用,若不適用,需具體闡述理由及相應的科學依據,并依據產品的具體特性對注冊申報資料的內容進行充實和細化。 時間:2022-10-4 10:24:04 瀏覽量:2472

-
定性檢測體外診斷試劑分析性能評估注冊審查指導原則(2022年第36號) 分析性能評估資料是評價產品安全有效性的重要支持性資料之一。科學合理地開展產品的分析性能評估,確定產品的各項分析性能指標,是產品設計開發的關鍵過程。本指導原則旨在指導注冊申請人對定性檢測體外診斷試劑進行充分的分析性能評估,并整理形成體外診斷試劑注冊?申報資料,同時也為技術審評部門審評注冊申報資料提供參考。 時間:2022-10-4 10:16:43 瀏覽量:1789

-
醫療器械注冊需要多少錢? 對于技術和費用來說,醫療器械都是高門檻行業之一。相比技術,更多企業關注醫療器械注冊需要多少錢?借國家藥監局發布《關于緩繳藥品、醫療器械產品注冊費的公告(2022年第81號)》這個機會,一起來聊聊醫療器械注冊費用這個事兒。 時間:2022-9-29 0:00:00 瀏覽量:1740

-
剛剛!藥監總局發布關于緩繳醫療器械產品注冊費的公告 剛剛,國家藥監局發布《關于緩繳藥品、醫療器械產品注冊費的公告(2022年第81號)》,2022年10月1日至2022年12月31日期間提交藥品、醫療器械產品注冊申請并獲受理的注冊申請人,自應繳注冊費之日起緩繳一個季度,不收滯納金。詳見正文。 時間:2022-9-29 0:00:00 瀏覽量:1594

-
持續葡萄糖監測系統注冊審查指導原則2022年修訂版(征求意見稿) 根據國家藥品監督管理局2021年度醫療器械注冊技術指導原則制修訂計劃的有關要求,國家藥監局組織修訂了《持續葡萄糖監測系統注冊審查指導原則2022年修訂版》,經文獻調研、企業調研、專題研討、專家研討形成了征求意見稿,即日起公開征求意見。 時間:2022-9-28 0:00:00 瀏覽量:1747

